Bedeutender Mechanismus in der Tumorabwehr von Natürlichen Killerzellen entdeckt
Einem Team um Projektleiterin Natascha Kleiter und PhD Student Johannes Wölk ist es in Zusammenarbeit mit KollegInnen an der Med Uni Innsbruck gelungen, die Rolle des Hormonrezeptors NR2F6 in natürlichen Killerzellen zu entschlüsseln. Die Ergebnisse eines Experiments zur Metastasenabwehr sind beeindruckend und kürzlich im Fachjournal Cell Death & Disease der Nature Gruppe veröffentlicht worden.
„Natürliche Killerzellen (NK-Zellen) sind essenzielle Komponenten des angeborenen Immunsystems und spielen eine entscheidende Rolle in der Abwehr von Tumoren. Sie besitzen die Fähigkeit, abnormale Zellen wie Tumorzellen und virusinfizierte Zellen ohne vorherige Sensibilisierung zu erkennen und zu eliminieren,“ erklärt Projektleiterin Natascha Kleiter.
Die Bedeutung von NK-Zellen in der Tumorabwehr liegt in ihrer Fähigkeit, veränderte Expressionsmuster von Oberflächenmolekülen auf Tumorzellen zu erkennen. Tumorzellen können durch den Verlust von MHC-Klasse-I-Molekülen oder die Expression von Stress-induzierten Liganden identifiziert werden, was die Aktivierung von NK-Zellen zur Folge hat.
In der Studie „Regulation of NK cell development, maturation, and antitumor responses by the nuclear receptor NR2F6“ untersuchte das Team um Johannes Wölk (Erstautor) und Natascha Kleiter (Seniorautorin) am Institut für Zellgenetik (Direktor: Gottfried Baier) in den vergangenen dreieinhalb Jahren die Rolle des nuklearen Orphan-Rezeptors NR2F6 in der Entwicklung, Reifung und antitumoralen Funktion von natürlichen Killerzellen (NK-Zellen). Johannes Wölk ist im Zuge der von David Teis geleiteten FWF-DocFund Initiative „Cellular Basis of Diseases: Molecular Control of Metabolism and Inflammation“ zu der Forschungsarbeit gekommen. Natascha Kleiter konnte zusätzlich für das vorliegende Projekt eine Förderung des Tiroler Wissenschaftsfonds einwerben.

BU: Projektleiterin Natascha Kleiter und Johannes Wölk beschäftigten sich dreieinhalb Jahre mit NRF26 und seiner antitumoralen Rolle in Natürlichen Killerzellen.
Die ForscherInnen fanden heraus, dass NR2F6 die Expression des aktivierenden Rezeptors NKp46 unterdrückt, welcher eine Schlüsselrolle in der NK-Zell-vermittelten Zytotoxizität spielt.
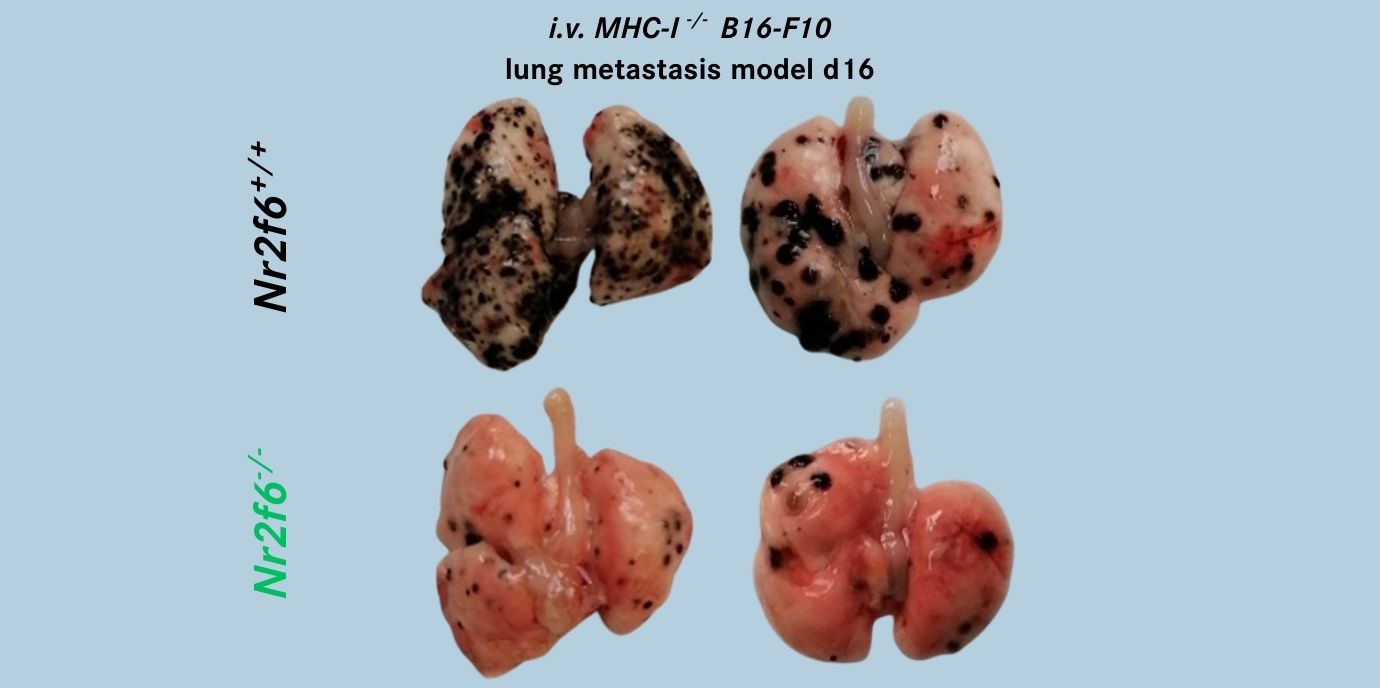
Mittels genetischer Mausmodelle zeigten die AutorInnen, dass der Verlust von NR2F6 die Expression des aktivierenden NK-Zell-Rezeptors NKp46 verstärkt, was zu einer erhöhten Tumorabwehr, insbesondere gegen Lungen-Metastasen, führte. Obwohl die Entwicklung von NK-Zellen im Knochenmark normal verläuft, zeigen NR2F6-defiziente Mäuse eine beeinträchtigte terminale Reifung der NK-Zellen in peripheren Geweben. Zudem ist die kurzfristige Reaktion dieser NK-Zellen auf Lipopolysaccharid (LPS) reduziert.
„Zusätzlich haben wir dann noch gemeinsam mit Patrizia Stoitzner die Interaktion von NK-Zellen mit myeloiden Zellen, das sind ebenfalls Immunzellen, untersucht. Dabei haben wir beobachtet, dass das geschwächte myeloide Kompartiment die NK-Zell-Aktivierung über IL-15 beeinträchtigt. Deshalb haben wir den Mäusen eine IL-15-Immuntherapie, die bereits in der Klinik zugelassen ist, verabreicht. In der Folge hatten die Mäuse überhaupt keine Metastasen mehr“, sagt Wölk.
Diese Ergebnisse deuten darauf hin, dass die therapeutische Modulation von NR2F6 eine vielversprechende Strategie zur Verstärkung der NKp46-abhängigen Tumorüberwachung und Metastasenbekämpfung darstellen könnten. Die Studie wurde unlängst im Fachjournal Cell Death & Disease (Nature-Gruppe) publiziert.
Aufgrund der vielversprechenden Resultate planen Natascha Kleiter und Johannes Wölk ihre Untersuchungen nun zu vertiefen und ein Mausmodell zu untersuchen in dem NR2F6 nur in NK-Zellen fehlt. In einem translationalen Folgeprojekt, das vom FWF im Matching-Funds Programm gefördert wird, werden die WissenschafterInnen dies künftig weiter erforschen.
(Innsbruck, 11. April 2025, Text: T. Mair/red. Foto und Grafik: MUI/Institut für Zellgenetik)
Forschungsarbeit:
Woelk J, Hornsteiner F, Aschauer-Wallner S, Stoitzner P, Baier G, Hermann-Kleiter N.: Regulation of NK cell development, maturation, and antitumor responses by the nuclear receptor NR2F6. Cell Death Dis. 2025 Feb 7;16(1):77. doi: 10.1038/s41419-025-07407-4. PMID: 39920136
Förderungen:
Austrian Science Fund (FWF) [Grant-DOI: 10.55776/P28694; 10.55776/DOC82]
Tiroler Wissenschaftsförderung (F.30904/7-2021);
Weitere Links:
Institut für Zellgenetik