Neu: Golgi-Apparat checkt Membranproteine
Neue Forschungsergebnisse aus dem Team von David Teis (Institut für Molekulare Biochemie) zeigen erstmals, dass der Golgi-Apparat nicht nur die Logistik-Zentrale der Zelle ist, sondern auch eine entscheidende Rolle bei der Qualitätskontrolle von Membranproteinen spielt. Fehlgeleitete und verwaiste Proteine werden im Golgi erkannt und zerstört. Dadurch wird verhindert, dass sich solche Proteine unkontrolliert über die Zelle ausbreiten und Membranen beschädigen.
Die Neubildung von Proteinen muss mit dem Abbau alter und fehlerhafter Proteine koordiniert werden. Diese Protein Homöostase (Proteostase) ist ein essentieller Prozess für das Funktionieren einer Zelle. Proteostase-Defekte führen zu Erkrankungen wie Krebs oder Neurodegeneration. Das Team um David Teis konnte bereits in mehreren Beiträgen neue Mechanismen und deren Mitspieler identifizieren, die das Gleichgewicht dieses Protein-Haushalts über selektive Abbauwege verwalten.

BU: v.l.: Theresia Dunzendorfer-Matt, Astha Purwar, Bettina Sarg, Xuechen Tang, Leopold Kremser, Sinead Iduna Schwabl, Yannick Weyer, David Teis, und Konstantin Siegmann.
Neue Kontrollfunktion
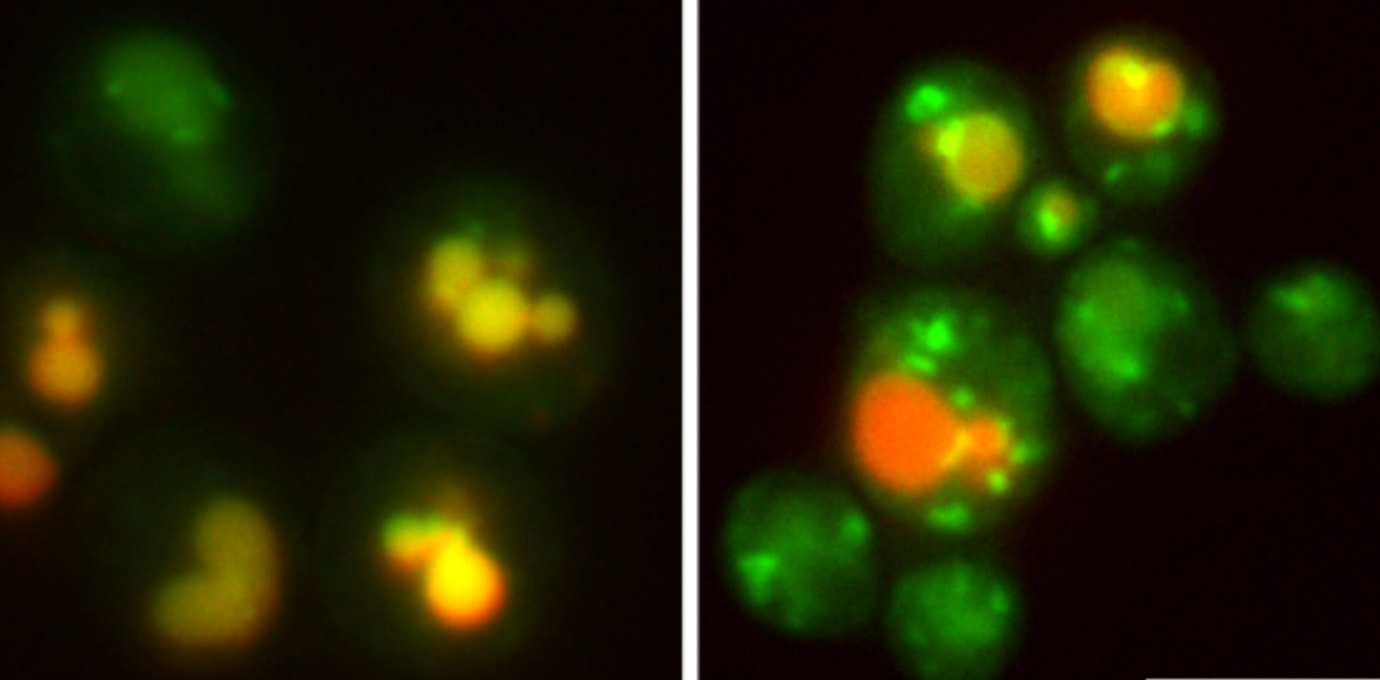
In der kürzlich, im Fachmagazin Nature Communications publizierten und unter der ErstautorInnenschaft von Yannick Weyer, Sinead Iduna Schwabl und Xuechen Tang entstandenen Arbeit, fokussierte sich das Team auf den Golgi-Apparat. „Von diesem Zellorganell wissen wir, dass es Proteine in Vesikel verpackt und für den Versand an ihren Bestimmungsort adressiert, so ähnlich wie ein Amazon-Logistik Center“, erklärt David Teis. Nun gelang es seinem Team erstmals nachzuweisen, dass der in der Golgi-Membran lokalisierte Dsc-Ubiquitin-Ligase-Komplex bestimmte Proteine auf deren Qualität hin kontrolliert. „Eine Untereinheit dieses Komplexes, Dsc2 – eine Rhomboid-Pseudoprotease – prüft, ob Membranproteine bzw. deren Transmembran-Domäne, die richtige Länge haben“, berichtet Yannick Weyer, der mit dieser Arbeit sein Doktorat abschloss. Wird die hydrophobe Länge einer Transmembran-Domäne als zu kurz bewertet, werden diese Proteine nicht für den Weitertransport freigegeben, sondern ubiquitiniert und dann über den EGAD Pfad aus der Golgi-Membran extrahiert und proteosomal abgebaut, oder über den ESCRT-Pfad lysosomal abgebaut (Referenz zur Abbildung).
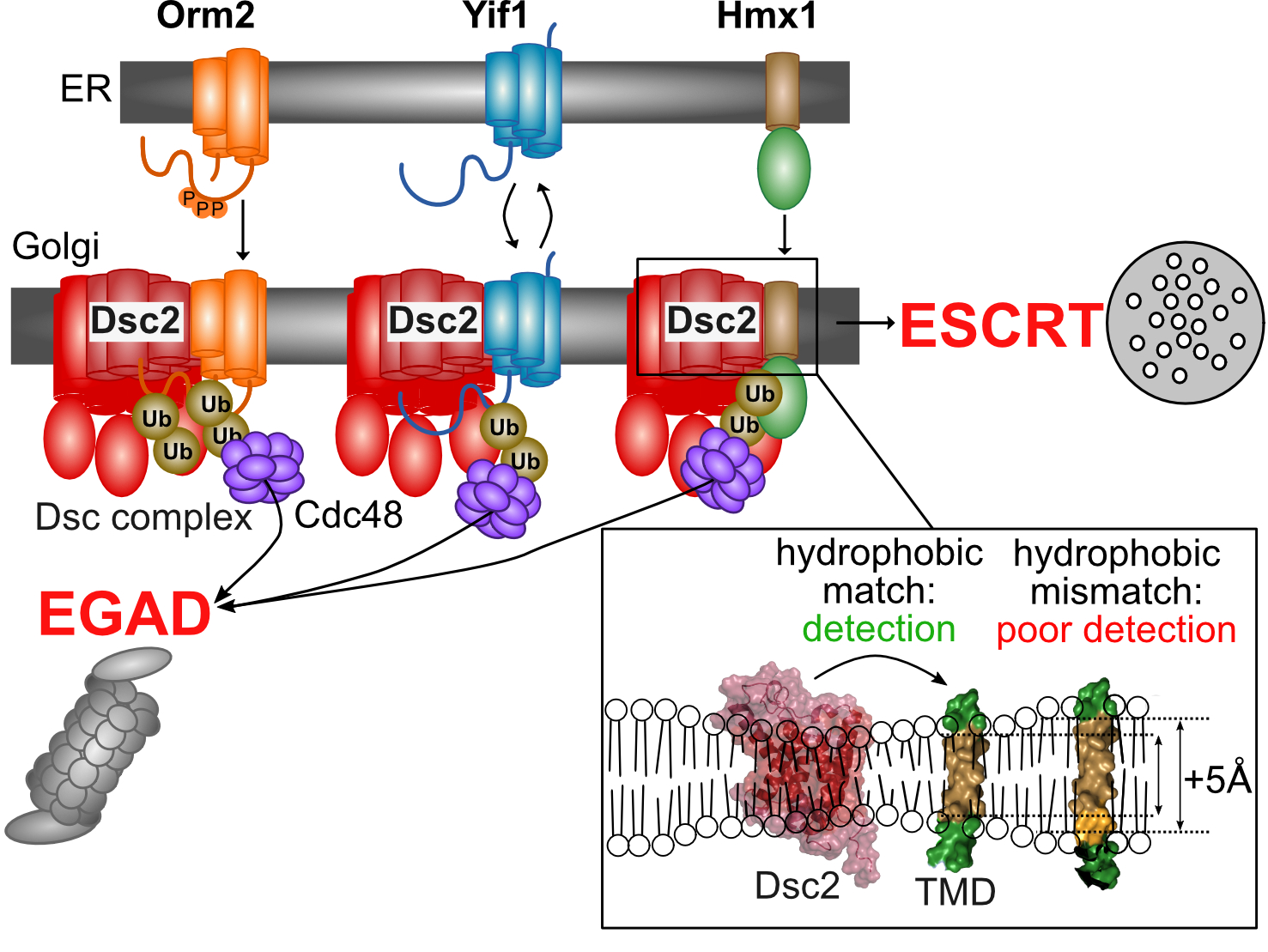
BU: Graphische Darstellung des Dsc-Komplex-vermittelten Abbaus von verwaisten Transmembranproteinen. Strukturmodelle von Dsc2 und der Transmembrandomäne von Hmx1. Unter Verwendung von AF erstellt.
„Der Dsc-Komplex vermittelt also den selektiven Abbau von verwaisten und fehlgeleiteten Proteinen am Sortierzentrum der Zellen, was ihre Verbreitung über andere Organellen verhindert und somit die Zusammensetzung der zellulären Membranproteine und -lipide erhält“, unterstreicht Teis. Akkumulieren verwaiste Proteine, sog. orphan proteins, an der falschen Stelle, führt das zu einer eingeschränkten oder fehlerhaften Funktion der Zelle. Für ihre Entdeckung bedienten sich die ForscherInnen der Bäckerhefe als eukaryotischen Modellorganismus, quantitativer Proteomics (gemeinsam mit der Protein Core Facility), Alphafold Modellen und ‚molecular dynamics simulations‘ (mit dem Institut für theoretische Chemie von Klaus Liedl, LFUI).
Die Gruppe um David Teis arbeitet nun daran, zusätzliche Faktoren der Golgi Qualitätskontrolle zu identifizieren: „Die vorliegenden Arbeit und das EMBO Paper von Oliver Schmidt (Schmidt O., et al 2019, EMBO J) formen die Basis für ein neues Feld: Membran-Qualitätskontrolle am Golgi. Ob dieses neue Konzept zur Qualitätskontrolle auch in humanen Zellen konserviert ist, und ob es eine relevante Rolle in der Entstehung von Erkrankungen spielt, ist im Moment unklar. „Allerdings war bisher noch jeder Prozess, den wir in Hefe entdeckt haben, in humanen Zellen konzeptionell konserviert. Das wird auch diesmal so sein“, schließt Teis.
Die vorliegende Arbeit entstand mit Unterstützung von FWF Einzelprojekten, des doc.funds Program Cellular Basis of diseases (DOC82) und des Luxembourg National Research Fund (Individual PhD Grant an Yannick Weyer).
(19.11.2024, Text: D. Heidegger, Bilder: Heidegger, Teis Lab)
Links:
The Dsc ubiquitin ligase complex identifies transmembrane degrons to degrade orphaned proteins at the Golgi. Weyer Y. et al., Nat Commun 15
https://doi.org/10.1038/s41467-024-53676-6
Endosome and Golgi-associated degradation (EGAD) of membrane proteins regulates sphingolipid metabolism. Schmidt O. et al., EMBO J
https://doi.org/10.15252/embj.2018101433
Institut für Molekulare Biochemie
Cellular Basis of Diseases (CBD) - Program