Ähnlich, aber doch ganz anders: Zwei Regulatoren des Fettstoffwechsels
Strukturell ganz ähnlich, aber im Effekt durchaus verschieden, so stellen sich die zwei Regulatoren des Enzymkomplexes SPT (Serine-Palmitoyltransferase) Orm1 und Orm2 dar. Die Analysen von Oliver Schmidt (Institut für Zellbiologie am Biocenter der Med Uni Innsbruck) in Kooperation mit zwei Forschungsteams aus Osnabrück wurden in Cell Reports veröffentlicht. Untersucht wurden Hefezellen, die Forschenden erhoffen sich aber langfristig Erkenntnisse über Erkrankungen wie Asthma oder Morbus Crohn.
Fünf Jahre lang hat der Zellbiologe Oliver Schmidt hauptsächlich über die Regulation dieses Enzyms geforscht. Und doch gab es für den gebürtigen Schwaben eine ziemliche Überraschung bei der Bestimmung der Struktur der Serine Palmitoyltransferase (SPT) in Bezug auf die Effekte zweier wichtiger Regulatoren dieses Enzyms in Hefezellen – Orm1 und Orm2. Sowohl in Hefe als auch in den menschlichen Körperzellen muss dieser Enzymkomplex sehr genau in seiner Aktivität kontrolliert werden. Hemmen die Regulatoren ihn zu stark oder zu schwach, kann das negative Auswirkungen haben – beim Menschen werden diese Regulatoren, sogenannte ORMDL-Proteine, etwa mit Krankheiten wie ALS (Amyotrophe Lateralsklerose), frühkindlichem Asthma oder Morbus Crohn in Verbindung gebracht.
Sphingolipide sind spezielle Fettmoleküle und einer der Hauptbestandteile in der Membran tierischer Zellen. Ein Mangel oder eine Überproduktion an Sphingolipiden führt zu einer falschen Zusammensetzung der Membranen und schweren Zell-Defekten. Die SPT ist das Schlüsselenzym der Sphingolipidsynthese. In Hefe gibt es zwei Regulatoren für die SPT (Orm1 und 2), im Menschen sogar drei (ORMDL1, 2 und 3). ORM(DL)-Proteine steuern somit den ganzen Sphingolipidhaushalt.
Strukturelle Ähnlichkeit war größer als erwartet
Im direkten Vergleich der beiden Proteine Orm1 und Orm2 in Hefe zeigte sich nun einerseits eine große strukturelle Ähnlichkeit, andererseits unterscheiden sie sich deutlich dadurch voneinander, wie gut beziehungsweise wie stark sie die SPT inhibieren, also hemmen können. „Dabei sind diese Proteine einander so ähnlich, dass man bei dieser Sequenzübereinstimmung eigentlich davon ausgehen würde, dass sie genau das Gleiche bewirken“, erklärt Schmidt, der am Institut für Zellbiologie (Direktor: Lukas Huber) im Biocenter der Med Uni Innsbruck tätig ist. Gemeinsam mit seinem Team forscht er am zellulären Lipidstoffwechsel.
„Die große Übereinstimmung in der 3D-Struktur war eigentlich überraschend“, resümiert Schmidt die Forschungsarbeit „The structure of the Orm2-containing serine palmitoyltransferase complex reveals distinct inhibitory potentials of yeast Orm proteins“, die kürzlich im Journal Cell Reports veröffentlicht wurde. „Man sieht wirklich nur lokal sehr kleine Unterschiede zwischen den Proteinen, die Bindung ist bis auf subtile Unterschiede nahezu identisch. Aber man kann trotzdem messen, dass Orm1 weniger inhibiert, das Enzym funktioniert damit immer noch recht gut. Mit Orm2 ist das Enzym nahezu abgeschaltet.“ Nachdem es also bei Hefe diese großen Unterschiede im inhibitorischen Potential gibt, ist das möglicherweise bei den drei humanen Regulatoren genauso. „Darüber weiß man noch nahezu gar nichts“, skizziert der Grundlagenforscher zukünftige Forschungsziele.
Ein Puzzle fügt sich zusammen
Für die Erkenntnisse hat Oliver Schmidt eng mit zwei Arbeitsgruppen der Universität Osnabrück zusammengearbeitet, die von Florian Fröhlich und Arne Möller geleitet werden. Auch Schmidts früherer PostDoc-Mentor David Teis, Direktor des Instituts für molekulare Biochemie der MUI, war an der Studie beteiligt. Mit den niedersächsischen KollegInnen gibt es schon seit 2019 Kooperationen. „Uns hier in Innsbruck lag ein Teil der Daten, die im Paper veröffentlicht wurden, schon länger vor“, erklärt Schmidt. „Aber wir konnten den Unterschied der Aktivität nicht am gereinigten Komplex zeigen. Wir hatten den Hinweis darauf aus den lebenden Zellen, also die Daten in vivo. Unsere Osnabrücker Kollaboratorinnen und Kollaboratoren hatten wiederum die gereinigten Komplexe und deren Struktur bestimmt. Sie haben genau diese Unterschiede gemessen, hatten aber noch keinen Hinweis darauf, dass das Ganze in lebenden Zellen tatsächlich so abläuft. Und so hat es einfach wunderbar zusammengepasst.“ Die Daten konnten wie bei einem Puzzle zusammengefügt und gemeinsam veröffentlicht werden. In Osnabrück wurden dafür Lipidomanalysen gemacht, also die Sphingolipid-Levels in den Zellen gemessen. Im Labor im Innsbrucker CCB (Centrum für Chemie und Biochemie) hat Oliver Schmidt hingegen an lebenden Zellen der Bäckerhefe geforscht.
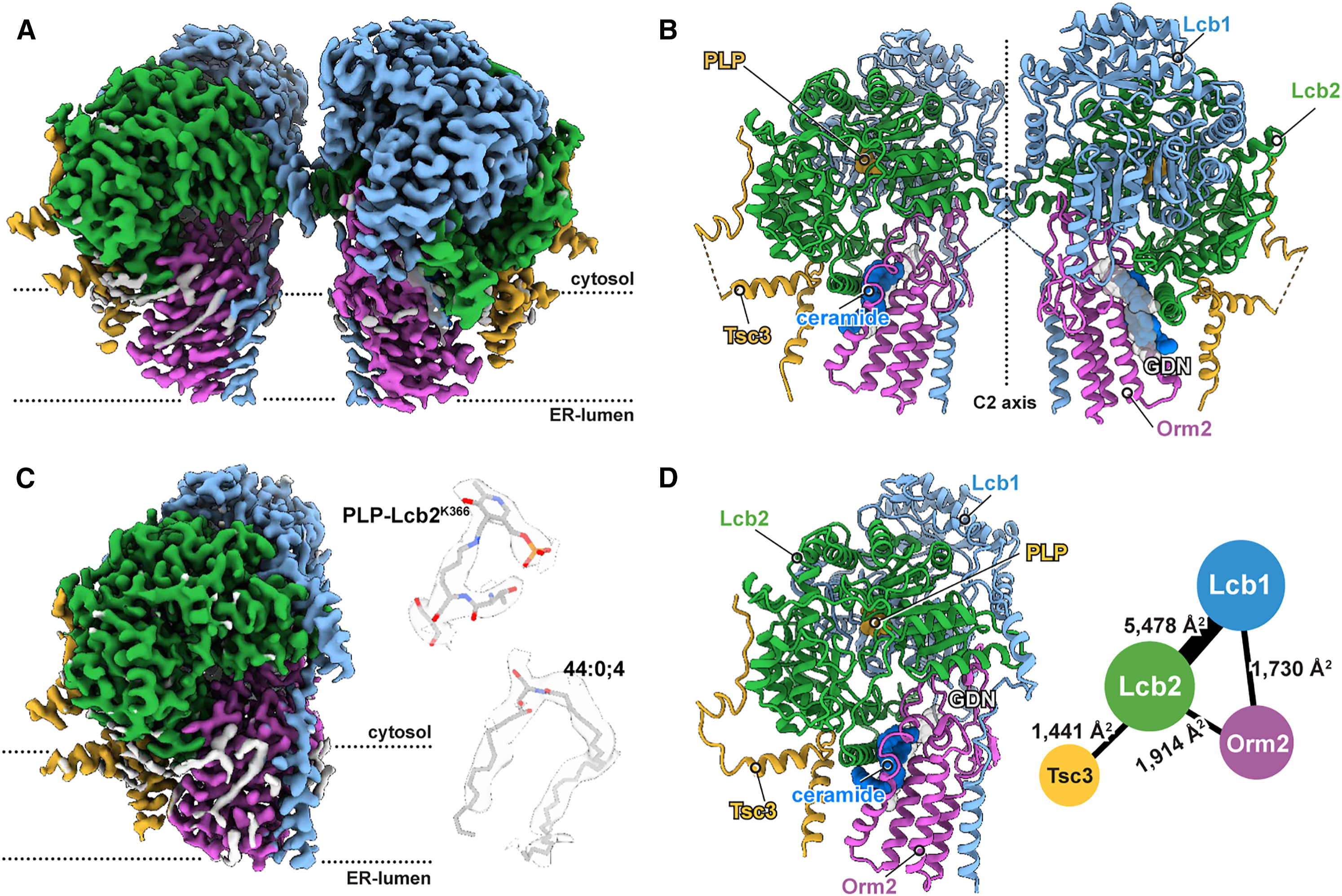
BU: Für die Arbeit wurde die Bindung von Orm1 und Orm2 an die SPT strukturell untersucht, dafür wurde der Enzymkomplex gereinigt und im Elektronenmikroskop analysiert (Grafik aus Forschungsarbeit*)
Vom Germ auf den Menschen schließen
Auch Germ ist ein eukaryotischer Organismus, die Zellen der Bier- oder Bäckerhefe, S. cerevisiae unterscheiden sich im Grundaufbau gar nicht wesentlich von menschlichen Zellen, erklärt Schmidt, der als Zellbiologe vor allem die Funktion der einzelnen Zelle im Fokus hat, im Gegensatz zu ihrer Funktion im Zellverbund. So sind auch Rückschlüsse auf die humane SPT möglich: „Die Bindung der ORMDL-Proteine ist nahezu identisch. Es gibt subtile Unterschiede, aber im Wesentlichen schaut dieser Enzymkomplex in Hefe und im Menschen gleich aus. Hefe hat dabei den Vorteil, dass sie ein deutlich einfacheres und somit leichter verständliches System ist. Das heißt, wo wir etwa 25.000 Gene haben, hat Hefe rund 6.000“, erläutert der Grundlagenforscher. Es gibt auch wenig ethische Bedenken bei der Forschung an Bäckerhefe. So ist sie seit über 50 Jahren als Modellorganismus etabliert.
Krankheitsbezug von SPT und ORMDL3 beim Menschen
Beim Menschen sind Mutationen auf der SPT mit Krankheiten assoziiert, darunter ALS. „Gewisse Mutationen stören die Bindung zwischen dem Enzym und seinem Regulator“, erklärt Schmidt. „Dann ist das Enzym unkontrolliert, es synthetisiert zu viele von diesen Sphingolipiden beziehungsweise von deren Vorstufen. Das ist für Zellen gar nicht gut – weder in Hefe noch im Menschen. Wenn das Enzym nicht kontrolliert wird, dann wachsen Hefen langsam, es geht ihnen schlecht, und beim Menschen führt das zu Krankheiten.“

BU: BU Oliver Schmidt (r.) forscht mit seinem Team am intrazellulären Lipidstoffwechsel, Teil des Teams „The Schmidt Laboratory“ sind Barış Bekdaş, Sophia Pichler und Brigitta Seifert (v.l.n.r.) und Niklas Schomisch (nicht im Bild, Foto: MUI/D. Bullock)
Auch ein Zusammenhang mit mehreren entzündlichen Krankheiten wie frühkindlichem Asthma, Morbus Crohn oder Inflammatory bowel disease ist bekannt. „Bei Asthma hat man dann möglicherweise zu viel des ORMDL3-Proteins, sodass das Enzym zu stark gehemmt wird“, erklärt Schmidt. Der Zusammenhang sei hier aber nicht so gut gesichert wie bei ALS. „Was relativ klar ist, ist, dass ganz bestimmte Polymorphismen (Variationen im Genom von einzelnen Personen) im Gen für ORMDL3 sehr stark mit diesen Erkrankungen assoziiert sind. Das heißt Menschen, die diese Variationen haben, erkranken statistisch häufiger daran als andere. Aber wie das funktional mit ORMDL3 zusammenhängt, das versteht man noch nicht.“ Dabei hat überraschenderweise nur ORMDL3 diesen spezifischen Krankheitsbezug, obwohl seine Sequenz zu über 90 Prozent mit ORMDL1 und 2 übereinstimmt.
Was die Regulatoren in Hefe betrifft, so wird sich in Zukunft etwa die Frage stellen, wie die Balance zwischen Orm1 und Orm2 hergestellt wird. Oliver Schmidt selbst möchte sich in Zukunft aber nicht nur der Regulation der Serine Palmitoyltransferase widmen, sondern auch die Steuerung von anderen Enzymen des Fettstoffwechsels erforschen – und dabei wiederum viel Neues entdecken.
(Innsbruck, 06.11.2024, Text: P. Volgger, Fotos: D. Bullock, Grafik: aus der Forschungsarbeit*)
*Forschungsarbeit:
Carolin Körner, Jan-Hannes Schäfer, Bianca M. Esch, Kristian Parey, Stefan Walter, David Teis, Dovile Januliene, Oliver Schmidt, Arne Moeller, Florian Fröhlich, The structure of the Orm2-containing serine palmitoyltransferase complex reveals distinct inhibitory potentials of yeast Orm proteins, Cell Reports, Volume 43, Issue 8, 2024; https://doi.org/10.1016/j.celrep.2024.114627)
Links:
Bericht Zelluläre Müllentsorgung: Innsbrucker Zellbiologen entdecken neuen Protein-Abbau-Weg mit unerwarteter Funktion auf Mypoint
https://www.i-med.ac.at/mypoint/news/728315.html
The Schmidt Laboratory
https://cellbiology.i-med.ac.at/research-groups/the-schmidt-laboratory/
Institut für Zellbiologie
https://www.i-med.ac.at/cellbio/




