Lysosomaler LAMTOR/Ragulator-Komplex kontrolliert Nährstoffhomöostase im braunen Fett
Der Eiweißkomplex LAMTOR ist bedeutsam für die Bildung von Fett und er reguliert die Aufnahme und Speicherung von Energie im braunen Fettgewebe. Eine gestörte LAMTOR-Funktion führt zu einer Anreicherung von Glykogen und Triglyceriden. Der AKT-Signalweg wird dadurch beeinträchtigt, was für Erkrankungen wie Diabetes oder Adipositas relevant ist. Zu diesen bedeutsamen Ergebnissen kam ein Team von ForscherInnen am Institut für Zellbiologie (Direktor: Lukas A. Huber) an der Med Uni Innsbruck.
Das braune Fett ist nur ein kleines Stück Gewebe im tiefen Nackenbereich. Für die Regulation des Stoffwechsels spielt es jedoch eine große Rolle. Im Gegensatz zum weißen Fettgewebe, das hauptsächlich der Energiespeicherung dient, ist das braune Fettgewebe auf die Wärmeerzeugung spezialisiert. Es enthält viele Mitochondrien, die thermogenetisch aktive Proteine produzieren. Gudrun Liebscher, Doktorandin im Labor von Lukas A. Huber (Direktor, Institut für Zellbiologie) ist zusammen mit Jörg Heeren (University Medical Center Hamburg-Eppendorf) und Dagmar Kratky (Gottfried Schatz Research Center, Medizinische Universität Graz), erstmals der Bedeutung des lysosomalen LAMTOR/Ragulator Komplexes für den Fettstoffwechsel auf den Grund gegangen. Das Fachjournal Molecular Metabolism veröffentlichte kürzlich die bemerkenswerten Ergebnisse, die neue Ansätze für die Entwicklung von Therapien gegen Stoffwechselerkrankungen bieten.
LAMTOR/Ragulator ist ein aus fünf Eiweißen bestehender Komplex, der den Stoffwechsel steuert. Er sitzt auf dem Lysosom, einer Organelle der Zelle, die als Proteinsteuerungsplattform und zelluläre Müllentsorgung fungiert. Huber hat mit seiner Arbeitsgruppe vor Jahren den LAMTOR Komplex identifiziert und seine Bedeutung für Aminosäurenstoffwechsel studiert (zur Publikation). LAMTOR besteht aus mehreren Untereinheiten, die die Rag-GTPasen ans Lysosom rekrutieren und dadurch die Aktivierung des mTORC1 in Abhängigkeit von Aminosäuren und anderen Signalen regulieren. Eine Störung der Funktion dieses so genannten LAMTOR/Ragulator kann zu Fehlfunktionen in Lysosomen (zur Publikation) und im mTOR-Signalweg führen und ist mit verschiedenen Stoffwechselerkrankungen verbunden, z.B. der Insulinresistenz und dem metabolischen Syndrom. Hier kommt das braune Fettgewebe ins Spiel.
Denn: Die Regulation des braunen Fettgewebes wird durch Insulinsignale genau kontrolliert. Wenn Insulin an seinen Rezeptor bindet, wird stromabwärts eine Kaskade von Signalen aktiviert, die die Glukoseaufnahme und die lysosomale mTORC1-Signalgebung aktivieren. Dieser Prozess erfordert den LAMTOR/Ragulator-Komplex, der den Nährstoffstatus der Zelle auf die jeweilige Kinase überträgt. Durch die genaue Regulation von Insulinsignalen und die Überwachung des Nährstoffstatus der Zelle kann dadurch der Energieverbrauch erhöht werden und so zur Gewichtsabnahme beitragen.
Liebscher untersuchte in der nun vorliegenden Arbeit, wie sich das Ausschalten von LAMTOR2 auf den Stoffwechsel im Organismus auswirkt. Sie züchtete dafür Mäuse, bei denen das Gen nur im Fettgewebe ausgeschaltet wurde. Danach testeten die ForscherInnen, wie die Mäuse auf unterschiedliche Temperaturen, Insulin oder Futter reagierten.
In der Folge zeigten die Mäuse zwar keine offensichtlichen Veränderungen im weißen Fettgewebe. Jedoch sammelten sich Triglyceride und Glykogen im braunen Fettgewebe, im Laufe der Zeit auch Triglyceride in der Leber an. Der Verlust der LAMTOR-Funktion am Lysosom führte bereits unter normalen Bedingungen zu einer Anreicherung von Glykogen innerhalb der Zellen, während die Synthese von neuen Fetten nicht induziert wurde. „Dies legt nahe, dass LAMTOR für die Entstehung und Reifung von Fettzellen notwendig ist. Dieser Mechanismus war zuvor nicht mit dem Lysosom in Verbindung gebracht worden“, schildert Huber.
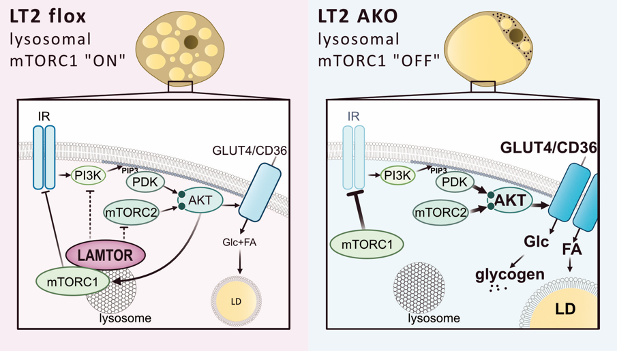
Links: Eine normale Situation mit intakter lysosomaler mTORC1-Signalisierung (in LT2 flox = "an").
Rechts: Ein Mangel des LAMTOR-Komplexes (LT2 AKO = "aus") führt zu einer erhöhten Phosphorylierung von AKT (Protein Kinase B), was wiederum die Häufigkeit von GLUT4 (Glukose Transporter 4) und CD36 (Fatty Acid Transporter) an der Zelloberfläche erhöht und somit den Einstrom von Glukose und Fettsäuren in die Zelle fördert. Die Glukose wird hauptsächlich als Glykogen gespeichert, da die Neubildung von Fettsäuren nicht angeregt wird. Trotzdem ist der mTORC1-Komplex (mechanistic target of rapamycin complex 1) in der Lage, IRS-1 (Insulin Receptor Substrate 1) zu hemmen.
Der Grund für diese Fehlfunktion liegt ihm zufolge wahrscheinlich darin, dass LAMTOR nicht nur die Aktivierung von mTORC1 im Lysosom vermittelt, sondern auch wichtig ist, um die Signalweiterleitung von mTORC2 an der Plasmamembran zu dämpfen. Diese Signalweiterleitung steuert die Regulierung von Energieaufnahme und -speicherung im braunen Fettgewebe. Es ist wahrscheinlich, dass die Fülle und Struktur der Lysosomen für beide Prozesse von entscheidender Bedeutung sind.
Weiters stellte sich bei den Untersuchungen heraus, dass sich ein LAMTOR-Knock-out wesentlich von einer mTORC1-Deletion unterscheidet. Obwohl mTORC1 aufgrund der genetischen Deletion von LAMTOR nicht mehr an das Lysosom gebunden war und seine Aktivierung dadurch gedämpft wurde, war es immer noch in der Lage, die klassische negative Rückkopplungsschleife zur Abschwächung der AKT-Signalisierung durch IRS-1 zu hemmen. Bei einem LAMTOR-Knock-out wird jedoch die AKT-Signalisierung nicht gedämpft.
„Dieses Forschungsergebnis hat große Bedeutung für das Verständnis des Stoffwechsels im braunen Fettgewebe. Die Entdeckung dieses homöostatischen Kreislaufs zeigt, wie verschiedene Signalwege im Körper interagieren, um den Stoffwechsel im braunen Fettgewebe zu regulieren“, resümiert Lukas Huber. In einem nächsten Schritt gehe es nun darum, mögliche Therapien, wie beispielsweise die Anwendung von klinisch bereits zugelassenen AKT-Inhibitoren, zur Behandlung von Fettstoffwechselstörungen auszuloten.
In einer weiteren Studie (zur Publikation), die Mitte Mai in der Fachzeitschrift Nature Communications veröffentlicht wurde, haben ForscherInnen gemeinsam mit internationalen PartnerInnen eine weitere Krankheit untersucht. Bei dieser Erkrankung sind LAMTOR und ein Bindungspartner am Lysosom betroffen. Die Ergebnisse zeigen, dass eine anhaltende Aktivierung von RagD die Aktivität von Transkriptionsfaktoren (MiT/TFE) blockiert, die Autophagie und Lysosomenentstehung regulieren. Dadurch kommt es zu fehlerhaften Stoffwechselreaktionen in den Zellen und zu lysosomalen oder mitochondrialen Schäden. Diese Veränderungen können zu Nierentubulopathie und Kardiomyopathie führen und möglicherweise auch bei anderen Krankheiten eine Rolle spielen. Diese Studien unterstreichen daher die Bedeutung der lsosomen mTOR Regulierung in der Entstehung verschiedenster Stoffwechselerkrankungen.
(Innsbruck, am 5. Juni 2023, Text: red. Bild: Histologie/Kristian Pfaller)
Publikationen
Structure of the lysosomal mTORC1–TFEB–Rag–Ragulator megacomplex
LAMTOR/Ragulator is a negative regulator of Arl8b- and BORC-dependent late endosomal positioning
RagD auto-activating mutations impair MiT/TFE activity in kidney tubulopathy and cardiomyopathy syndrome
Links:
Institut für Zellbiologie
Forschungsgruppe Prof. Jörg Heeren Hamburg
Forschungsgruppe Prof. Dagmar Kratky Graz
Forschungsgruppe Prof. Andrea Ballabio, Neapel
The lysosomal LAMTOR / Ragulator complex is essential for nutrient homeostasis in brown adipose tissue
Molecular and Cellular Biology of Diseases (MCBD) PhD program