Neues zur Effektivität oraler und intravenöser Eisenersatztherapien
Schätzungsweise eine Milliarde Menschen weltweit sind von ACD, der Anämie chronischer Erkrankungen, betroffen. Bis heute sind die optimale Therapie wie auch die Wirksamkeit von oralen und intravenösen Substitutionstherapien mit Eisen bei ACD schwer fassbar, auch, weil es weiterer differentialdiagnostischer Parameter bedarf. Nun legen Forschende um den Infektiologen Günter Weiss neue Daten vor, die für die klinische Praxis höchst relevant sind.
Bei länger bestehenden Entzündungsreaktionen, etwa aufgrund von Infektionen, Autoimmunerkrankungen, Tumoren oder chronischen Herz-, Lungen- und Nierenerkrankungen kommt es zu Veränderungen des Eisenstoffwechsels und in der Folge zur Anämie chronischer Erkrankungen (ACD). Diese Form des „funktionellen“ Eisenmangels ist durch die vermehrte Speicherung von Eisen in den Fresszellen des Immunsystems (Monozyten, Makrophagen) bedingt: Der Körper versucht, die Mikroben oder Tumorzellen in ihrem Wachstum einzuschränken, indem er die Verfügbarkeit des für deren Stoffwechsel wichtigen Elements Eisen limitiert – mit dem Nachteil, dass Eisen auch für die lebenswichtige Blutbildung nicht mehr zur Verfügung steht. Dem gegenüber entsteht eine Eisenmangelanämie (IDA) meist infolge von Blutungen, man spricht von einem absoluten Eisenmangel.
„ACD und IDA bestehen oft nebeneinander, was die Differentialdiagnose als auch die Wahl der richtigen Therapieform erschwert. Eine Eisensubstitution ist die Erstlinientherapie für die klassische Eisenmangelanämie, doch ob die orale oder die intravenöse Verabreichung – beide Therapieformen sind zugelassen – bei ACD wirksam ist, kann bislang nicht zufriedenstellend beurteilt werden“, beschreibt Günter Weiss, Direktor der Univ.-Klinik für Innere Medizin II und ausgewiesener Experte auf dem Gebiet des Eisenstoffwechsels, die Ausgangslage zweier unlängst erschienener Forschungsarbeiten unter seiner Federführung, die auch im Rahmen seines CD-Labors für Eisenmetabolismus und Anämieforschung entstanden sind. „Bei in vivo-Untersuchungen konnten wir feststellen, dass bei Eisenmangelanämie beide Verabreichungsformen gleich gut wirken, doch bei einer ACD, in unserem Fall ein Rattenmodell mit Arthritis, erwiesen sich beide Formen als ineffizient, da orales Eisen nicht aufgenommen und intravenöses Eisen in der Leber gespeichert wird und somit nicht ins Knochenmark gelangt, wo die Blutbildung stattfindet. Bestehen jedoch beide Anämien nebeneinander – was in der Praxis häufig der Fall ist – wirken beide Therapieformen wieder ähnlich gut, allerdings mit dem Nachteil, dass die intravenöse Eisengabe letztlich zu vermehrter Entzündungsreaktion führt“, beschreibt Lara Valente De Souza, Erstautorin dieser Studie, die im Fachjournal Haematology veröffentlichten Ergebnisse.
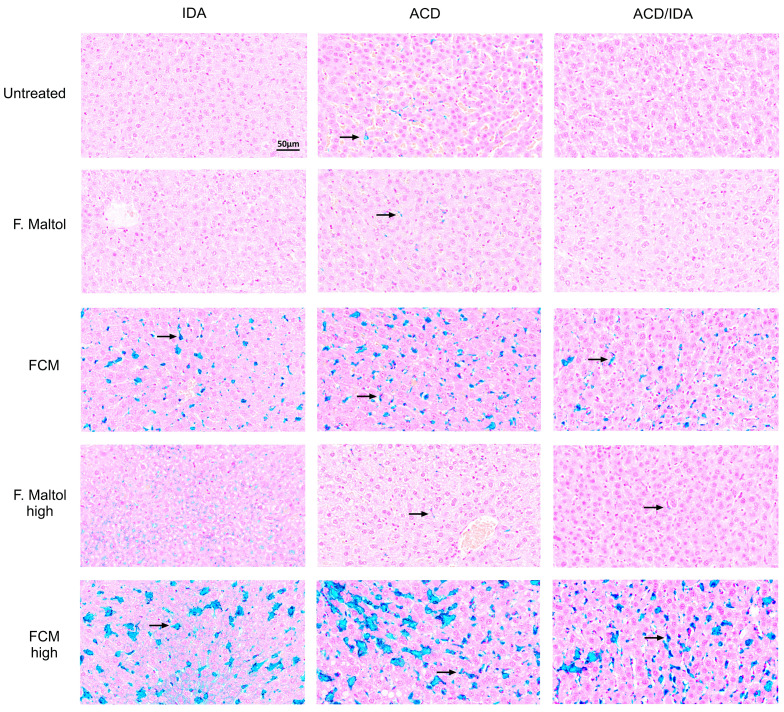
BU: Eine intravenöse, nicht aber eine orale Eisenbehandlung führt insbesondere bei Vorliegen einer Entzündung zu einer Eisenakkumulation in den Kupffer-Zellen. Leberschnitte wurden zum Eisennachweis mit Berliner Blau gefärbt. Der blaue Bereich entspricht der Eisenfärbung (schwarze Pfeile). Verschiedene Tiermodelle sind senkrecht, unbehandelte und behandelte Gruppen horizontal gezeigt. Maßstabsleiste, 50 µm. Die gezeigten Ergebnisse stammen von 1 repräsentativen Experiment und 1 repräsentativen Tier pro Gruppe. (c)Haematology/Lara Valente De Souza
Die Untersuchung zeigt erstmals die vergleichende Effektivität von Eisentherapien und wie die Eisenverteilung die Entzündung beeinflusst. „Bei ACD ist es wichtig zu wissen, ob zusätzlich ein klassischer Eisenmangel vorliegt, und wie der Körper das Eisen verteilt. Weitere differentialdiagnostische Informationen sind für die Wahl der optimalen Therapieform also ausschlaggebend, um die beste individuelle Behandlung zu finden und unnötige bzw. wirkungslose Applikationen zu vermeiden“, so Weiss.

BU: Klinikdirektor Günter Weiss mit den ErstautorInnen der beiden Forschungsarbeiten, Lukas Lanser und Lara Valente De Souza sowie den RadiologInnen Benjamin Henninger und Michaela Plaikner (v.l.), (c) C.Simon
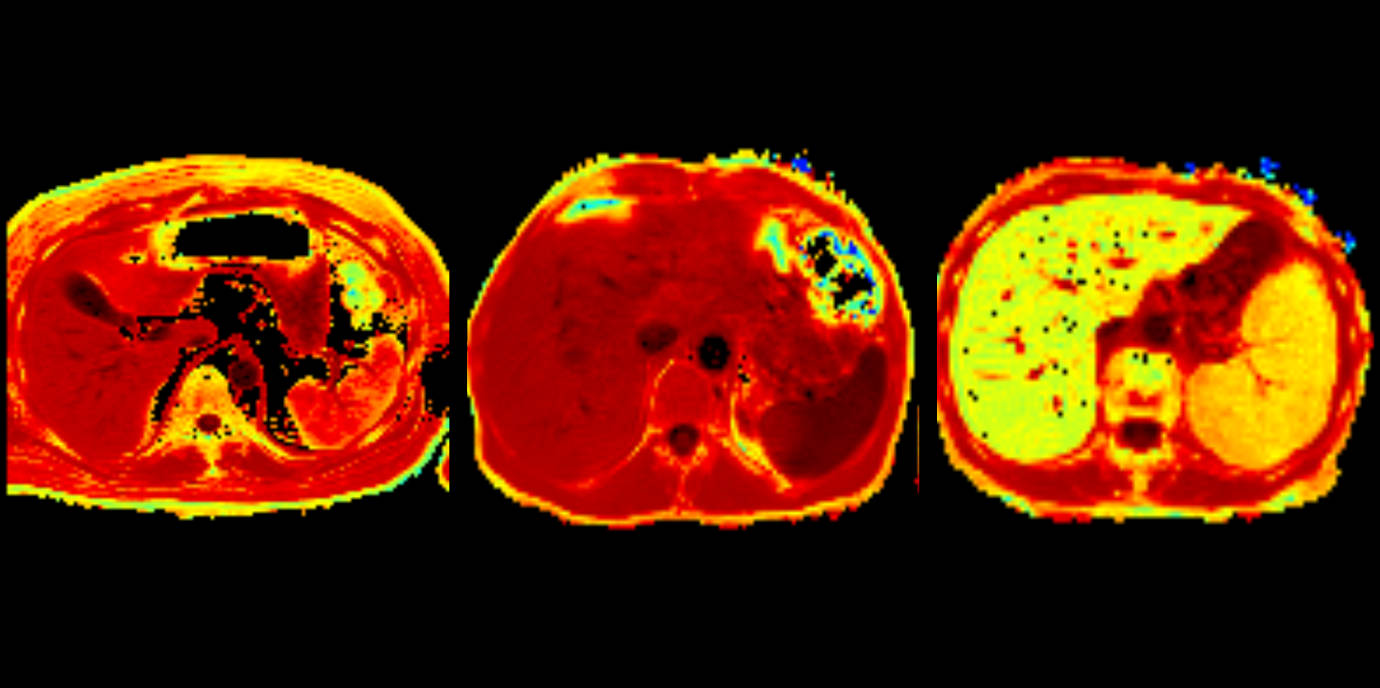
Hier kommt eine weitere Forschungsarbeit ins Spiel, die das Ergebnis optimaler und nicht zuletzt standortspezifischer interdisziplinärer Zusammenarbeit ist. Gemeinsam mit den RadiologInnen Benjamin Henninger, Christian Kremser und Michaela Plaikner ging das Team um Weiss der Frage nach, wie Eisen bei ACD-PatientInnen mit und ohne absolutem Eisenmangel im Gewebe gespeichert wird. In dieser ersten prospektiven Kohortenstudie im Menschen wurde der Eisengehalt in Milz, Leber, Bauchspeicheldrüse und Herz mittels MRT analysiert und mit der Ferritinkonzentration im Serum – ein sensitiver Labormarker für die Diagnose eines absoluten Eisenmangels – gematcht. „Wir konnten feststellen, dass bei ACD und gleichzeitigem blutungsbedingten Eisenmangel weniger Eisen in der Milz gespeichert wird. Bei Entzündung und einem Ferritinwert unter 200 zeigt die Bildgebung jedoch eine erhöhte Eisenakkumulation in der Milz. Diese Ergebnisse stützen unsere Erkenntnisse aus dem Tiermodell, dass bei einer derartigen Konstellation die Patientinnen wohl kein effektives Ansprechen auf eine Eisentherapie hätten“, berichtet Lukas Lanser als Erstautor dieser Arbeit.
MRT-bezogene Eisenmessungen können folglich dazu beitragen, den tatsächlichen Eisenbedarf besser zu charakterisieren und bessere Biomarker-Schwellenwerte bei der Diagnose einer absoluten Eisenmangelanämie im Rahmen einer ACD zu definieren. „Die MRT wird sich als brauchbare diagnostische Methode qualifizieren, um die Therapie der Anämie zu optimieren“, ist Günter Weiss überzeugt.
Hintergrund Eisenstoffwechsel und Anämieforschung
In Forschungsleistungen zu immunologischen Mechanismen der Infektionsabwehr und dem Eisenstoffwechsel, besonders im Hinblick auf genetische Störungen der Eisenaufnahme (Hämochromatose), der Anämie chronischer Erkrankungen (ACD / Infektions- und Tumoranämie, Etablierung eines Tiermodells für ACD) und der Bedeutung von Eisen für die Immunabwehr und den Verlauf von Infektionen (Host-Pathogen-Interaktion), liegt die besondere Expertise und das internationale Renommee von Günter Weiss und seinem Team an der Univ. Klinik für Innere Medizin II begründet. Im 2017 gestarteten Christian Doppler Labor für Eisenmetabolismus und Anämieforschung unter der Leitung von Günter Weiss stehen systemische Untersuchungen der therapeutischen Effektivität etablierter und neuer oraler und intravenöser Eisenpräparate bei Entzündungsprozessen im Fokus, um die ACD-Therapie zu optimieren und sekundäre Effekte dieser Medikamente zu identifizieren.
(13.04.2023, Text: D. Heidegger, Bilder: Plaikner/Haematology/deSouza/Simon)
Links:
Tissue iron distribution in patients with anemia of inflammation: Results of a pilot study. Lukas Lanser et al., Am J Hematol. 2023 Mar 7. doi: 10.1002/ajh.26909. Online ahead of print.
https://doi.org/10.1002/ajh.26909
Comparative analysis of oral and intravenous iron therapy in rat models of inflammatory anemia and iron deficiency. Lara Valente De Souza et al., Haematologica, 2023 Jan 1;108(1):135-149.
https://doi.org/10.3324/haematol.2022.281149
Review: The role of iron in chronic inflammatory diseases: from mechanisms to treatment options in anemia of inflammation. Marques O, Weiss G, Muckenthaler MU. Blood. 2022 Nov 10;140(19):2011-2023.
https://doi.org/10.1182/blood.2021013472
CD-Labor für Eisenmetabolismus und Anämieforschung
Univ.-Klinik für Innere Medizin II